Descripción
La electroforesis es un método de separación de biomoléculas como el ADN o ARN de acuerdo a su tamaño, permitiendo además su aislamiento cortando la zona de interés. La electroforesis en ácidos nucleicos es muy versátil, porque permite una observación directa de cada fragmentos separado directamente en el gel, ya que, su tinción mediante un compuesto llamado bromuro de etidio, hace visible al ADN o ARN (fluoresce) mediante la emisión de luz ultravioleta. Cuando una corriente eléctrica se aplica sobre el gel de agarosa el ADN tiene una carga negativa y migra hacia el ánodo (polo positivo).
La agarosa es un polímero lineal de galactosa y 3,6-anhidrogalactosa. El gel se obtiene disolviendo la agarosa en un buffer de TAE o TBE y se funde usando un microondas, hasta obtener una solución homogénea y transparente. La disolución se vacía en un molde y se coloca un peine (el peine forma unos pozos donde se depositan las muestras). Se deja enfriar para polimerizar para formar una matriz porosa variando el tamaño del poro según la concentración de agarosa contenida en la disolución. Además, la migración de los fragmentos de ADN variarán dependiendo del tamaño, conformación molecular (lineal, circular, superenrollado), concentración de la agarosa en el gel, voltaje, dirección del campo eléctrico, presencia de colorantes añadidos que se intercalan en el ADN (como el bromuro de etidio y SYBR-green) y de la composición del buffer en el gel.
Cuando el ADN se deposita en los pozos del gel debe mezclarse con un buffer de carga (Tabla loading buffer) este permite:
1) aumentar la densidad de la muestra para depositarse en el fondo del pozo
2) teñir la muestra para facilitar su carga dentro del gel
3) identificar la distancia recorrida por las muestras:
La migración del colorante contenido en el buffer de carga en un gel con 0.5–1.4% Agarosa.
Los colorantes migrarán partiendo del mismo punto que el ADN y ayudan a indicar la posición de corrimiento del ADN en el gel de agarosa.
NOTA: Los tamaños son aproximados.
| Colorante | Tamaño aprox. |
| GoTaq® azul | 4 kb |
| Xileno cianol FF | 4 kb |
| Azul de bromofenol | 300 bp |
| Naranja G | 50 bp |
| GoTaq® amarillo | 10 bp |
Porcentaje de Gel: Resolución de ADN lineal en geles de agarosa.
| Recomendado % | Resolución óptima para ADN lineal (bp) |
| 0.5 | 1,000–30,000 |
| 0.7 | 800–12,000 |
| 1.0 | 500–10,000 |
| 1.2 | 400–7,000 |
| 1.5 | 200–3,000 |
| 2.0 | 50–2,000 |
Materiales
- Matraz de 250 mL
- Probeta 100 mL
- Micropipetas
- Microondas
- Camara de electroforesis horizontal
- Guantes de nitrilo
- Balanza analíticá
Reactivos
- Agarosa
- Ácido Bórico ≥ 99.5%
- Ác. Acético glacial
- Tris base
- Glicerol
- Xileno cianol
- Azul de bromofenol
Procedimiento
- Para preparar un gel de agarosa al 1% se debe pesar 1g de agarosa y este se disuelve en 100 mL de buffer TAE 1X o TBE 1X (ver tabla de Comparación de buffers).
- Caliente la mezcla contenida en un matraz ex profeso, en un horno de microondas dando pulsos de 30 segundos hasta lograr una mezcla homogénea. NOTA: evite la ebullición violenta de la mezcla.
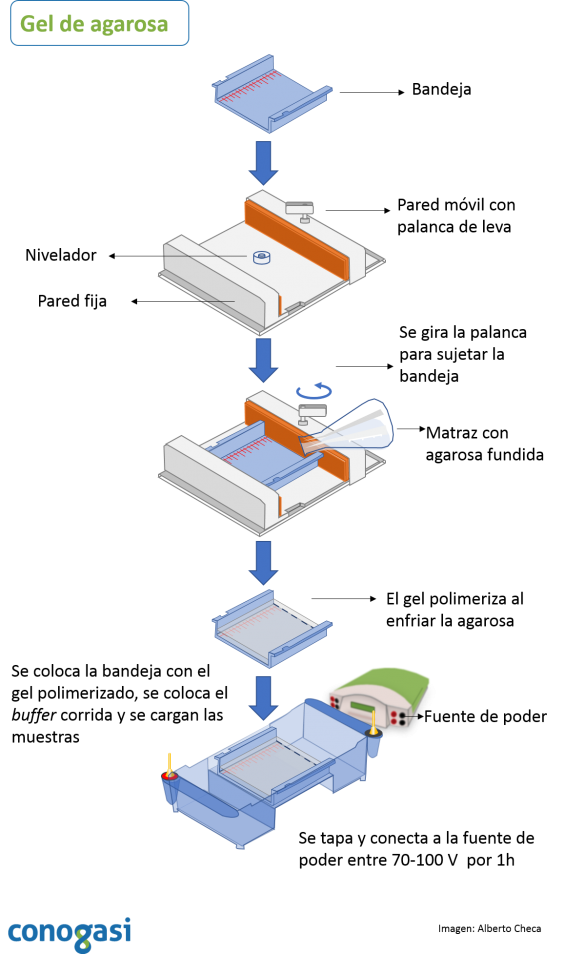
- Coloque la bandeja en el caster gel y gire la palanca de levas. Cerciórese de que cierra herméticamente. NOTA: se debe nivelar el “gel caster” antes de colocar la bandeja
- Si no tiene un caster gel puede utilizar cinta adhesiva en ambos extremos de la bandeja
- Vacíe con mucho cuidado la mezcla caliente de agarosa/buffer caliente evitando hacer burbujas y coloque un peine en un extremo. NOTA: no agregar muy caliente la mezcla sobre la bandeja
- Se deja enfriar hasta que polimeriza el gel
- Se colocan de 2-20 µg/µL de muestras de ADN en cada pozo con buffer de carga (ver tabla 1)
- Se corre el gel a 70 volts por una hora o una hora y media. NOTA: el tiempo y el voltaje requerirán de una estandarización
- Se retira el gel y se deja tiñendo 30 min. en la disolución del buffer que anteriormente se ha seleccionado y se agrega bromuro de etidio (EtBr). El EtBr se agrega a una concentración entre 200-500 ng/mL en el gel de agarosa. NOTA: El EtBr es mutagénico y por lo tanto se debe manejar con mucho cuidado. Se puede utilizar SYBR-green desde que se carga la muestra y es 25 veces más sensible que el EtBr usando un transiluminador estándar a 300 nm.
TAE 50X
| Tris Base 2M | 242.0g |
| Ac. Acético Glacial | 57.1mL |
| EDTA 0.5 M, pH 8.0 | 100mL |
| Aforar con H2O ultra pura | 1000mL |
TBE 50X
| Tris Base 2M | 242.0g |
| Ác. Bórico | 55 g |
| EDTA 0.5 M, pH 8.0 | 400mL |
| Aforar con H2O ultra pura | 1000mL |
Tabla 1. buffer de carga (6X). NOTA: almacenar a 4°C
| glicerol | 30% (v/v) |
| Azul de bromofenol | 0.25% (p/v) |
| Xileno Cianol FF | 0.25% (p/v) |
Tabla 2. Comparación entre los buffers TBE vs TAE
| Características del Buffer | TBE | TAE | Observaciones |
| Capacidad de Buffering | Alto | Bajo | TAE deja de funcionar adecuadamente en tiempos prolongados de electroforesis o en varias repeticiones |
| Migración del ADN bicatenario | Lento | Rápido | TAE tiene mejor conductividad |
| Resolución | Alta resolución en fragmentos largos | Alta resolución fragmentos cortos | TBE soporta mejor la reticulación de la agarosa que el TAE |
| Modificación enzimática | Si | No | El Borato del TBE es un inhibidor de muchas enzimas |
| Recuperación de ADN del gel de agarosa | Baja | Alta | El Borato del TBE interactúa con el ADN |
| Integridad del ADN | Alta | Baja | El Borato del TBE inhibe la actividad enzimática incluyendo las enzimas que modifican el ADN |
| Concentración de trabajo | 1X | 0.5X | Menor concentración del TAE durante la electroforesis |
| Costo | Costoso | Barato |
Cómo citar: Checa Rojas, A. (2017, 26 de Octubre ) Método: Gel de electroforesis Agarosa. Conogasi, Conocimiento para la vida. Fecha de consulta: Julio 26, 2024
Esta obra está disponible bajo una licencia de Creative Commons Reconocimiento-No Comercial Compartir Igual 4.0




Deja un comentario
8 Comentarios en "Método: Gel de electroforesis Agarosa"
Para ser tan pesada con las tildes pones pocas
Excelente
Muy buena información
ERROR en la tabla 2 de la comparación entre los buffers TAE y TBE.
El buffer TAE se utiliza para fragmentos grandes de ADN (900-2000pb)
Y el buffer TBE se utiliza para fragmentos cortos de ADN ( 100-500pb)
Y el link de donde proviene la información de ese cuadro no es confiable. Ya que redirecciona a otra cosa.
buenos dias por que las bandas en el tgel no se ven o migran de mas saludos
sildenafil 120 mg is the best drug that is used in the treatment of erectile brokenness. compound action which brings about a more circulatory framework into the penis during sexual excitement. like most other ED drugs, it works by relaxing the muscles that supply blood to the erectile tissue of your penis, simplifying it for you to get and keep an.