Introducción
La transferencia de proteínas o western blot es una técnica muy usada en áreas de biología celular, bioquímica y biología molecular. La técnica usa tres pasos para llevarla a cabo:
- La separación de proteínas por peso molecular en geles de poliacrilamida
- La transferencia a una membrana o soporte sólido, que permite su manipulación
- El marcaje de la proteína blanco utilizando un anticuerpo primario y un anticuerpo secundario acoplado a una molécula que permite su visualización. NOTA: puede haber anticuerpos primarios ya acoplados con moléculas que permiten la visualización de la proteína blanco.
Materiales
- Gel con proteínas cargadas y separadas previamente (ver abajo)
- Camara de transferencia semiseca para Western blot
- Papeles whatman No1 o 2 del tamaño del gel. NOTA: 6 papeles whatman por cada gel
- Recipientes del tamaño del gel. NOTA: ahí se colocará el buffer de corrida, el metanol y se pondran a incubar con los anticuerpos. Se puede usar tubos de 50 mL
- Membrana de PVDF o nitrocelulosa
- Bisturi o tijera
- Fuente de poder
Reactivos
- Tris Base
- Glicina
- NaCl
- HCl
- Tween 20
- Albumina Bovina/leche descremada tipo Svelty
- Ácido acético
- Acetato de sodio
- Anticuerpos primarios y secundarios
- N,N-Dimetilformamida ≥98%
- 3-Amino-9-etilcarbazol
- H2O2
Procedimiento
Carga y corrida del gel
- En el primer carril cargue el marcador de peso molecular. NOTA: se usan preferentemente marcadores preteñidos
- Cargue concentraciones entre 20-30 μg de proteína total o de 10-100 ng de proteína purificada y llévelos a volúmenes iguales y colóquelos en los pozos del gel SDS-PAGE.
- Corra el gel durante 40 min – 1 hora a 150 V o 35mA. NOTA: El tiempo y corriente eléctrica pueden requerir optimización.
Porcentaje de acrilamida en el gel/tamaño de la proteína de interés
| Tamaño de la Proteína | % del Gel |
| 4–40 kDa | 20% |
| 12–45 kDa | 15% |
| 10–70 kDa | 12% |
| 15–100 kDa | 10% |
| 25–100 kDa | 8% |
NOTA: Los geles de gradiente también pueden ser utilizados.
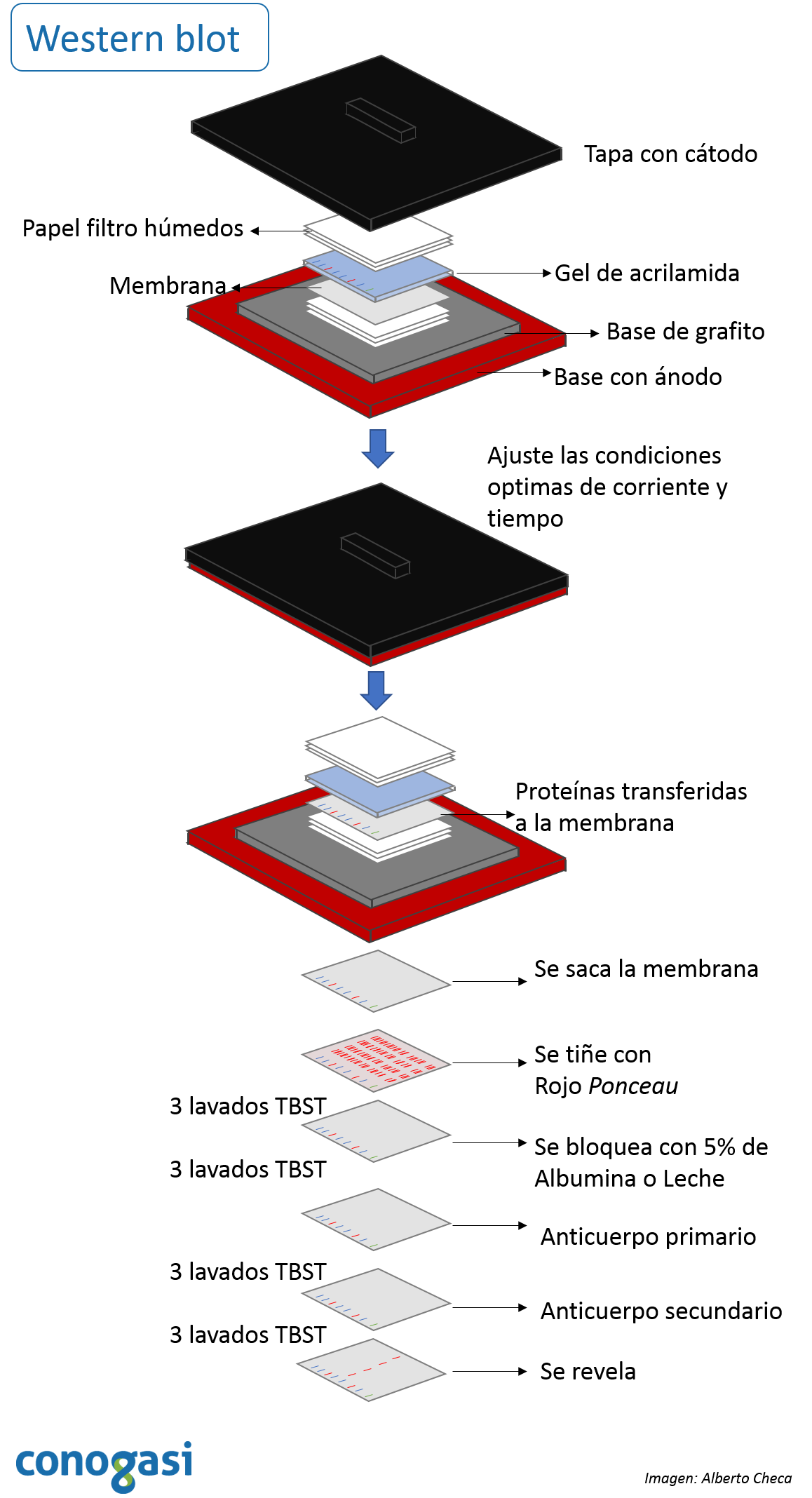
Transferencia semi-seca de las proteínas del gel a la membrana
NOTA: Para este procedimiento se pueden utilizar membranas de nitrocelulosa o PVDF.
- Después de correr el gel de poliacrilamida se deja el gel en buffer WBTB 1X
- Se equilibran las membranas de PVDF colocandolas en metanol durante 1 minuto y posteriormente se lavan con buffer WBTB 1X; si es de nitrocelulosa se coloca en el buffer WBTB 1X.
- Se colocan 3 papeles whatman del tamaño de la membrana empapados de buffer WBTB 1X.
- Posteriormente se coloca la membrana previamente equilibrada y lavada
- Y enseguida se coloca el gel sobre la membrana y 3 papeles whatman encima del gel. NOTA: se debe cerciorar de no dejar burbujas que bloqueen la transferencia
- Se cierra cuidadosamente la cámara y se conecta a la fuente de poder. NOTA: El tiempo y el voltaje de la transferencia pueden requerir cierta optimización.
- La transferencia de proteínas de la membrana se puede verificar usando la tinción con Rojo Ponceau S antes del paso de bloqueo o marcadores preteñidos. NOTA: se pude checar cuidadosamente la transferencia separando el gel de los marcadores esto ayuda a observar si la transferencia es completa.
- Terminando la transferencia se bloquea con Albumina bovina sérica (BSA) al 5% o con leche descremada al 5% en TBST 1X por 10min en agitación.
- Se hacen 3 lavados con TBST 1X y se preparan los anticuerpos según las recomendaciones del fabricante en TBST (1:10,000, 1:5000, etc.). NOTA: todos los anticuerpos requieren una estandarización previa.
- Se puede dejar toda la noche en agitación a 4°C o a temperatura ambiente 2 horas.
- Se retira el anticuerpo y se realizan 3 lavados con TBST por 2 min
- Se prepara y coloca el anticuerpo secundario con las características del fabricante y se deja en agitación a temperatura ambiente 2 horas
- Se retira el anticuerpo y se realizan 3 lavados con TBST por 2 min
- Dependiendo de la molécula con la que este acoplado el anticuerpo secundario será el procedimiento a seguir.
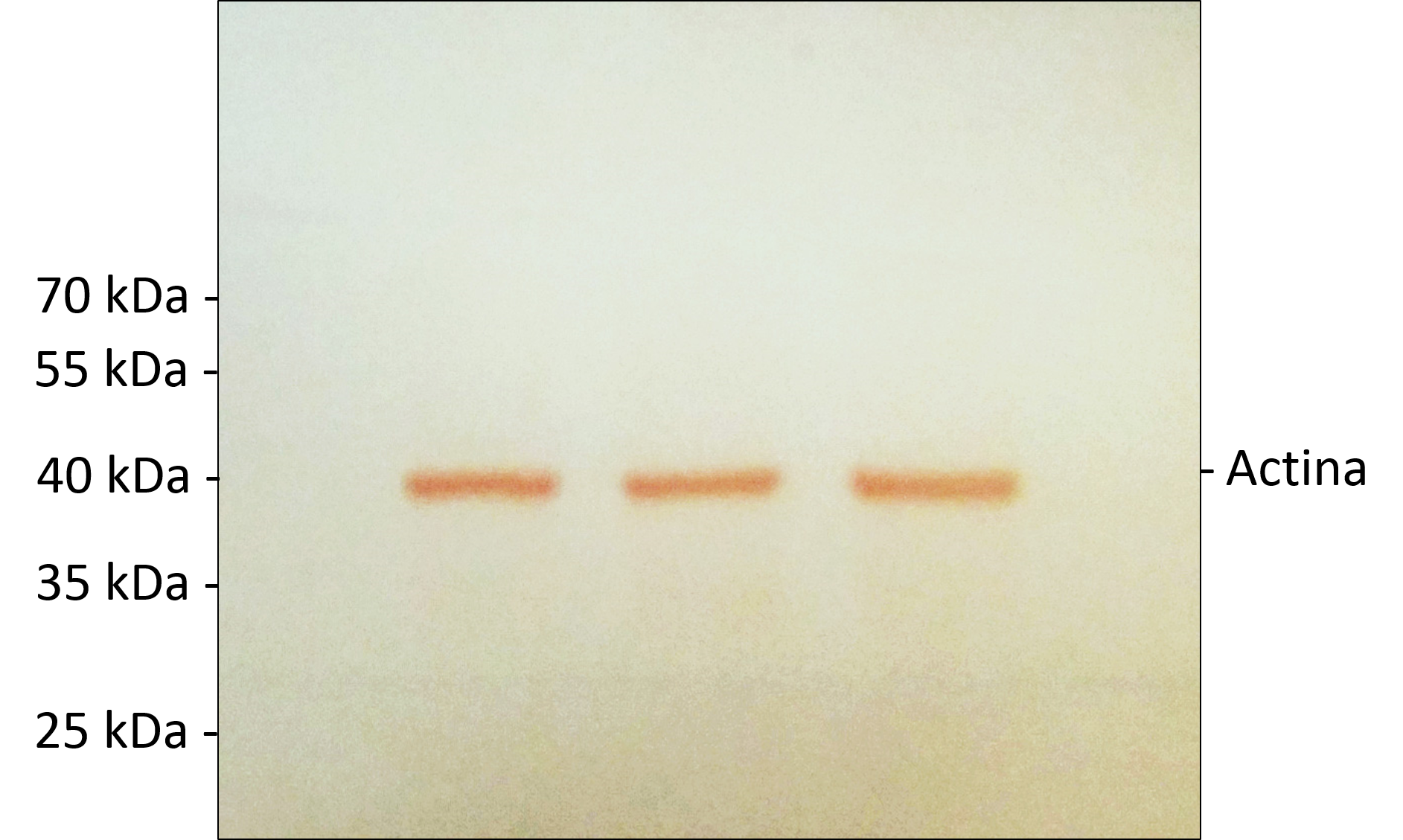
- Si los anticuerpos están acoplados a HRP se pueden realizar una reacción colorimétrica con Carbazol.
- Agregue en un tubo de 15mL, 2.25 mL de la disolución Stock de Carbazol (ver tabla), y posteriormente agregue 6 mL de buffer de Acetatos (ver tabla abajo) y 15 µL de H2O2
- Coloque la membrana en un recipiente y posteriormente la mezcla de Carbazol y espere a que las bandas se tiñan de un color Rojo carmesí (ver fotografía abajo).
Para prepara el sándwich de para la corrida de western blot debe ser de la siguiente manera:
Western Blot Transfer Buffer: WBTB 10X
| Tris base | 30,3g |
| Glicina | 144g |
| Ajustar pH a | 8.6 |
| Aforar a | 1L |
NOTA: al preparar la disolución al 1X se debe agregar 20% de metanol, para 1L:
Se agregan 100 mL del WBTB 10X, se agregan agua ultra pura o bidestilada 400 mL , se añaden los 200 mL de metanol y se afora a 1L.
TBST 10X
| Reactivo | para 1L 10X | Concentración Final 1X |
| Tri base | 12.11g | 10mM |
| NaCl | 80.8g | 138mM |
| Aforar a | 1L |
NOTA: colocar Tween al 0.1% al preparar la disolución 1X
Stock de Carbazol para 100mL
| Carbazol | 800mg |
| N,N-dimetilformamida | 100mL |
Buffer de Acetatos pH 5.2
| Acetato de sodio | 13.6 g |
| dH2O | 800 mL |
| ajustar el pH a 5.2 con | ácido acético |
| Aforar a | 1L |
Ejemplo de una tinción con Carbazol:
Cómo citar: Checa Rojas, A. (2017, 27 de Octubre ) Método: Western blot (transferencia semi-seca). Conogasi, Conocimiento para la vida. Fecha de consulta: Septiembre 16, 2025
Esta obra está disponible bajo una licencia de Creative Commons Reconocimiento-No Comercial Compartir Igual 4.0





Deja un comentario
1 Comentario en "Método: Western blot (transferencia semi-seca)"
Tengo tres comentarios: Está muy claro, me gustan las imágenes, y con datos precisos para hacer una corrida de gel. Dos: Le faltan acentos, lo cual puede verse trivial, pero sin duda le va a pegar negativamente a conogasi; y tres: va muy rápido al grano. Con unas cuantas frases al inicio, podría el no experto quedarse con la idea clara de: para qué sirve el método, qué se logra? Por eso 3 estrellas resulta hasta elevada mi calificación. Ojalá lo mejores. Saludos