Hace algunos años, una maestra de química entró al salón de clase con un vaso de agua en la mano. Lo colocó en el escritorio y preguntó a sus estudiantes que había allí. –¡Agua!, -¡agua sola!, –¡agua simple! fueron muchas de las respuestas que se escucharon y no faltó quien añadiera también, –achedoso (H2O) recordando que era la fórmula química recién aprendida para designarla. -Lo que hay en cada vaso de agua, es un ejemplo perfecto de la maravilla de la naturaleza, nos dijo la maestra y comenzó a explicarnos poco a poco los “puentes de hidrógeno”.
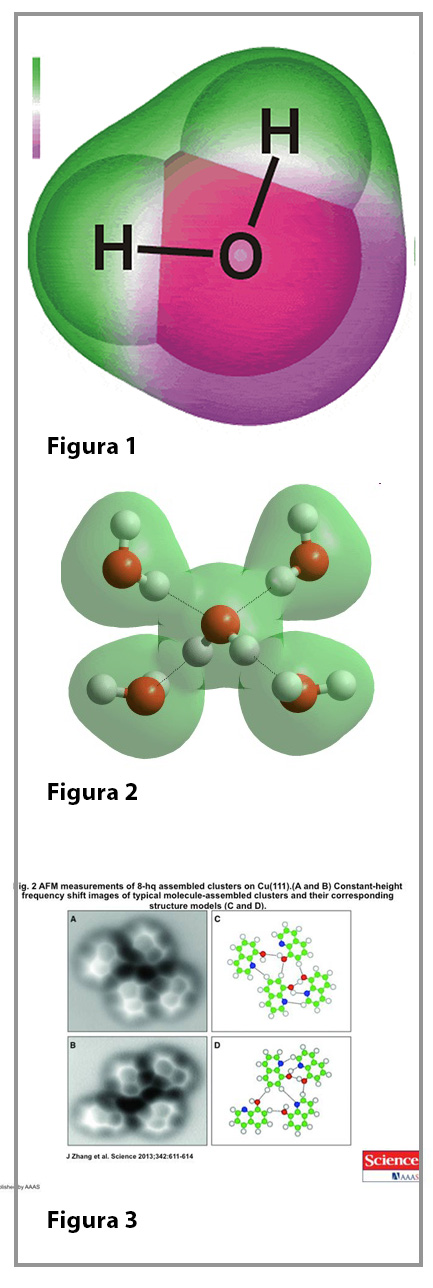
La molécula de agua, formada por un átomo de oxígeno y dos de hidrógeno es una molécula polar, es decir, la forma en la que está distribuida su densidad electrónica genera una zona rica en electrones y otra bastante pobre. En la figura 1 es posible observar la disposición de los átomos y en distintos tonos su densidad electrónica; se le designa como el polo negativo al que tiene mayor densidad y al otro como el polo positivo. La existencia de estas dos regiones en una misma molécula conduce a que la forma en la que se acomodan muchas moléculas sigue un orden y dirección particular: el polo negativo de una molécula se orientan hacia el positivo de la molécula vecina. En la molécula de agua los polos o regiones de interacción se distribuyen en los vértices de un tetraedro; dos de ellos son negativos, en la región donde está el oxígeno y dos positivos, en la zona que corresponde a los hidrógenos, con lo cual, cada molécula puede formar interacciones hasta con cuatro moléculas vecinas, cada una de estas interacciones corresponde a un puente de hidrógeno, como se ilustra en la figura 2. Se le llamó de esta manera puesto que el átomo de hidrógeno de cada molécula actúa como un puente entre los átomos de oxígeno de moléculas vecinas.
La existencia e importancia de estas interacciones fue un asunto que causó gran polémica en el mundo científico a finales del siglo XIX. En Holanda Johannes D. van der Waals, un maestro de ciencias en secundaria, obtuvo su doctorado en 1873 con una tesis en la que demostraba que el paso del estado gaseoso al estado líquido se podía explicar si se considera el tamaño de las moléculas y la interacción entre ellas. Este último punto resultaba controversial. Los modelos que explicaban los enlaces entre átomos para formar moléculas eran aún muy limitados y no se sabía aún de la existencia de las partículas que forman el átomo. Por tal razón, la propuesta de que las moléculas podían interactuar entre sí era difícil de acomodar en el pensamiento científico de la época. No obstante, los cuidadosos experimentos que van der Waals hizo lograron convencer a algunos de la importancia de estas fuerzas que actúan a nivel molecular. De hecho, en 1910 recibió el Premio Nobel de Física por sus contribuciones a la comprensión de la relación entre el estado líquido y el gaseoso.
En el inició del siglo XX el trabajo de físicos y químicos logró un avance fundamental en la comprensión a nivel molecular de la naturaleza de la materia. Entre 1910 y 1920 fue posible identificar que las fuerzas intermoleculares eran responsables de las propiedades químicas de algunas substancias y el libro de texto más importante de química en el siglo XX, La Naturaleza del Enlace Químico, escrito por Linus Pauling ya incluía, en 1939, un capítulo para las interacciones entre moléculas y describía allí los puentes de hidrógeno en el agua que ahora se conocen como enlaces de hidrógeno o enlaces por puente de hidrógeno.
El estudio de esta interacción ha sido uno de los temas más fascinantes debido a que poco a poco se fue descubriendo que la estructura y propiedades, no sólo del agua, sino de todas las moléculas biológicas está íntimamente relacionada con estas interacciones. La fuerza necesaria para romper esta interacción entre moléculas es entre 40 y 50 veces menor que la necesaria para romper un enlace químico entre dos átomos lo cual permite que se rompan y se formen muchas veces sin cambiar la composición química del sistema y, sobre todo, sin un gasto de energía considerable, como si fueran el pegamento de las notas adhesivas que tanto usamos ahora.
El estudio de las interacciones intermoleculares empleando métodos de la química teórica ha favorecido una mejor comprensión de la estructura de las substancias líquidas y sólidas; también ha sido posible interpretar algunos resultados experimentales que muestran que el comportamiento de algunas substancias depende crucialmente de las interacciones que establecen con moléculas vecinas, por ejemplo las del disolvente. Otro aspecto que ha resultado fascinante es encontrar algunas de las razones que ayudan a explicar el fenómeno de reconocimiento molecular, es decir, la forma en la que en un medio en el que pueden haber muchas moléculas distintas sólo algunas de ellas establecen interacciones particulares que pueden modificar las propiedades del medio. Este es un fenómeno que está directamente relacionado con la evolución molecular de la vida. La fuerza conductora de la organización molecular está constituida de miles de millones de pequeñísimas interacciones entre moléculas distintas que se “reconocieron” por la posibilidad de establecer interacciones entre ellas. Este reconocimiento puede haber conducido a la generación de estructuras más grandes o bien a la posibilidad de reaccionar químicamente y formar moléculas más complejas.
En aquella clase de química en la que escuché por primera vez hablar de los puentes de hidrógeno recuerdo que alguien preguntaba cómo se podían ver los puentes de hidrógeno. La respuesta en ese momento era que, al igual que las moléculas, sus dimensiones son tan pequeñas que no había ningún instrumento capaz de observarlas. Mi maestra de química ya no vio que este año un grupo de investigadores de China logró imágenes de moléculas unidas por enlace de hidrógeno. Empleando microscopía de fuerza atómica es posible ver a los átomos. Esta técnica detecta la densidad electrónica sobre una superficie muy pequeña; los sitios en los que la densidad electrónica es alta corresponden a los lugares en los que están ubicados los átomos y de esta forma un mapa de densidades puede interpretarse como una imagen de átomos y/o moléculas. Lo sorprendente del trabajo del grupo de X. Qiu publicado por Science en el mes de noviembre es que han logrado detectar con gran sensibilidad la densidad electrónica asociada a la formación de los enlaces de hidrógeno. La figura 3 muestra una imagen del trabajo de este grupo. Sin duda alguna, una confirmación más de la existencia de estas interacciones que con tanto escepticismo se consideraron cuando van der Waals habló por primera vez de ellas.
Artículo publicado originalmente “El pegamento de la vida” en el periódico Unión de Morelos por miembros de la Academia de Ciencias de Morelos A.C.
Cómo citar: Autor, C., Margarita I. Bernal-Uruchurtu Centro de Investigaciones Químicas, UAEM Miembro de la Academia de Ciencias de Morelos (2018, 21 de Septiembre ) El pegamento de la vida. Conogasi, Conocimiento para la vida. Fecha de consulta: Abril 19, 2024
Esta obra está disponible bajo una licencia de Creative Commons Reconocimiento-No Comercial Compartir Igual 4.0





Deja un comentario
Sé el primero en comentar!