El oro es un elemento raro y por eso es tan caro. El oro es un metal de transición y tiene propiedades fisicoquímicas fuera de lo común, entre ellas su enorme maleabilidad, ductilidad y conductividad eléctrica. Además, no se oxida ni en el aire ni en el agua y mantiene un brillo amarillo que ha fascinado a la humanidad por milenios. Recientemente, un grupo de astrofísicos del Instituto Smithsoniano de Harvard encontró evidencia sólida de que el oro se forma cuando dos estrellas de neutrones chocan formando un hoyo negro, en un evento singular que libera una gran cantidad de radiación de muy alta energía [1].
Para comprender la frase “el oro se forma” es necesario recordar que este elemento figura en el lugar 79 de la tabla periódica de Mendeleyev con el símbolo Au; eso significa que su núcleo se caracteriza por tener 79 protones (partículas de carga positiva). Como los átomos son neutros, tienen 79 electrones (partículas de carga negativa) girando alrededor del núcleo. Ahora la pregunta es ¿por qué es raro el oro? La respuesta tiene que ver con el gran número de protones que tiene en su núcleo y con la forma en que interactúan las partículas cargadas eléctricamente.
Sabemos que dos partículas cargadas interactúan como lo enuncia la ley de Coulomb. Esta ley dice dos cosas: la primera es que partículas que tienen el signo opuesto se atraen, y si tienen el mismo signo se repelen. La segunda es que la fuerza de atracción o repulsión Fc es proporcional al producto de las cargas (q1 y q2) e inversamente proporcional al cuadrado de la distancia entre ellas (r), Fc= K q1q2/r2, donde K es la constante de Coulomb. Cabe hacer énfasis en que la distancia entre protones en un núcleo atómico es del orden de 10-13 m, o sea de 0.000,000,000,01 cm. Como la fórmula de Coulomb dice que la fuerza entre un par de protones es repulsiva (positiva) e inversamente proporcional al cuadrado de esta pequeñísima distancia, la fuerza de repulsión entre dos protones es enorme, y la fuerza de repulsión entre un protón y el resto del núcleo de oro es, aproximadamente, 78 veces mayor aún. Esto nos lleva directamente al problema de la estabilidad de los núcleos de los átomos, ya que éstos contienen cargas positivas que son la suma de las cargas de todos los protones que los componen. Aquí la pregunta lógica es ¿por qué no explota un núcleo que tiene dos o más protones?
Resulta evidente que si aplicamos únicamente la ley de Coulomb a la descripción de un núcleo con dos o más protones es imposible explicar su estabilidad y, sin embargo, nosotros mismos somos prueba de que núcleos multicargados positivamente existen en la naturaleza. Entonces debe haber algo más que permita que un gran número de protones se encuentre confinado en volúmenes tan pequeños como los de un núcleo atómico. Aquí es donde los neutrones (partículas sin carga eléctrica) entran en juego, ya que su presencia hace posible la estabilidad de los núcleos. El mecanismo detallado que permite evitar la explosión Coulómbica tiene su origen en la sub-estructura de los protones y neutrones, que están compuestos por tríos de partículas aún más pequeñas, llamadas quarks. Es interesante mencionar que los quarks tienen cargas eléctricas fraccionarias de -2/3, -1/3, +1/3 y +2/3, con lo cual combinaciones de dos quarks up (qu=+2/3) y un quark down (qd=-1/3) producen la carga qp=+2/3+2/3-1/3=+1 del protón. La carga 0 del neutrón se obtiene como combinación de dos quarksdown (-1/3) y un quark up (+2/3). El rápido intercambio de quarks entre protones y neutrones al interior del núcleo ocurre por una fuerza atractiva que contrarresta y vence a la repulsión coulombiana, la llamada Fuerza “fuerte”. De este modo, la presencia de otro tipo de fuerzas atractivas no-Coulómbicas entre quarks permite la estabilidad global de esa “sopa dinámica” de protones y neutrones que llamamos núcleo.
Regresando a la descripción simple de los núcleos atómicos, observamos que ésta requiere de dos números: la carga total Z (el número de protones) y la masa total A del núcleo. Aquí consideraremos (por simplicidad) que la masa de un protón es igual a 1 en unidades atómicas (ua), cuando en realidad es 1.007276 ua. Los neutrones tienen una masa de 1.008664 ua, ligeramente mayor que la de los protones. De esta forma la masa A (expresada en unidades atómicas) es aproximadamente el número de protones más el número de neutrones. Ahora resulta interesante analizar cómo aumenta A con Z, es decir cuántos neutrones A-Z se requieren para estabilizar un núcleo con Z protones. El primer núcleo compuesto es el del helio, porque tiene dos protones. En este punto aparece el concepto de isótopos de un elemento. Los isótopos están definidos por el diferente número de neutrones que pueden tener los núcleos con un mismo número de protones. Ilustremos esto con el caso más sencillo, el núcleo de helio que tiene dos protones. Existen dos isótopos del helio: el que tiene sólo un neutrón llamado 3He, y el que tiene dos neutrones, llamado 4He. Lo mismo ocurre para la mayoría de los elementos de la tabla periódica, en donde existe más de un tipo de núcleo, aunque todos ellos con el mismo número de protones. El ejemplo más conocido es el del famoso carbono-14 (14C), que es un isótopo inestable (con seis protones y ocho neutrones) que decae naturalmente al isótopo “normal” más abundante en la naturaleza, el 12C que tiene seis neutrones y seis protones. Este decaimiento ocurre, en promedio, en un lapso que se conoce como vida media de una especie radioactiva; en el caso del 14C, es de 5568 años. Este decaimiento radioactivo permite determinar con notable precisión la fecha en el pasado en que existió un organismo vivo, ya que éstos integran a su organismo el CO2 de la atmósfera y en ella existe una proporción conocida de 14C/12C.
Ahora podemos regresar a nuestro estudio del número de neutrones para núcleos con Z protones analizando los datos básicos que se encuentran en la tabla periódica de los elementos. Allí encontraremos que se requiere aproximadamente el mismo número de neutrones que de protones para estabilizar un núcleo con Z protones hasta Z=20, es decir, A es aproximadamente 2Z hasta el núcleo de calcio. A partir de 20 protones se requiere cada vez más de un número mayor de neutrones para estabilizar núcleos con carga mayor. Por ejemplo el bromo, con 35 protones tiene ya una masa de 80, no de 70=2×35. La plata, con 47 protones tiene una masa de 108, no de 94. Para el oro, con 79 protones, la masa es ya de 197. El uranio representa el caso extremo de los núcleos que existen en la naturaleza, ya que su isótopo más estable, el 238U, tiene 92 protones y requiere de 146 (238-92) neutrones para no explotar por repulsión Coulómbica.
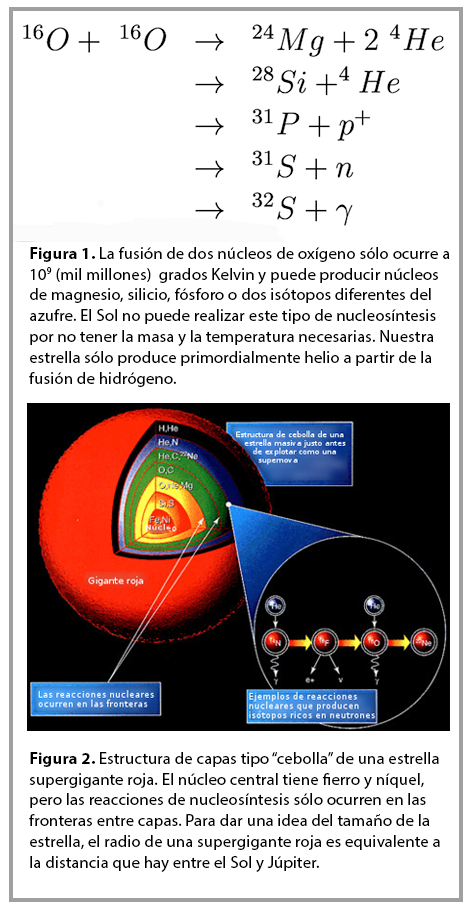
Aquí podemos preguntarnos: ¿cuál es el número Z de protones que produce el núcleo más estable? La respuesta, que tomó años en ser encontrada, es Z=26 y corresponde al núcleo de fierro. Esto quiere decir que núcleos que tengan más de 26 protones van, eventualmente, a decaer emitiendo fragmentos de ellos mismos hasta formar núcleos de fierro. Así, los núcleos con más de 26 protones son menos abundantes que el fierro y, como es de esperarse, los núcleos con mayor número de protones son aún más raros. Esta aseveración es confirmada en la proporción de metales como el oro, plata, iridio, platino, renio, erbio, gadolinio, torio y uranio que se encuentran en la corteza terrestre. Los científicos que estudian cómo se forman los diferentes núcleos de cadaelemento de la tabla periódica han desarrollado una teoría coherente llamada de nucleosíntesis. Ésta explica los mecanismos que llevan a la formación de núcleos atómicos cada vez más pesados. Las reacciones que producen núcleos más pesados a partir de núcleos ligeros ocurren únicamente en el interior supercaliente de las estrellas durante la combustión de material para poder contrarrestar el colapso gravitacional de la estrella [2]. Sólo las temperaturas en el interior de las estrellas, del orden de millones de grados, permiten la fusión nuclear (ver figura 1). De esta forma, todos los átomos de carbono, oxígeno, nitrógeno y azufre que contiene nuestro cuerpo fueron formados en una o varias estrellas que explotaron hace miles de millones de años. La figura 2, muestra la estructura de capas (parecida a una cebolla) de una estrella supergigante roja justo antes de que explote como supernova. Nótese que las reacciones de nucleosíntesis ocurren en las fronteras entre las diferentes capas que, por gravedad, contienen núcleos más pesados mientras más cerca del centro se encuentran.
Los restos de estas explosiones de supernova son el material del que está constituido nuestro Sistema Solar. Sabemos ahora que todos los elementos más ligeros que el magnesio (Z=12) son producidos mediante procesos de nucleosíntesis en el interior de las estrellas. Sin embargo, la formación de núcleos más pesados que el magnesio (con más de 12 protones) requiere de mucha más energía (léase temperatura) y para esto se requiere de eventos catastróficos, como la explosión de una supernova. La abundancia relativa de los elementos desde el magnesio hasta el níquel (Z=28) se ha podido explicar con el mecanismo de nucleosíntesis por supernova. La producción de núcleos más pesados, desde el cobre (Z=29) hasta el uranio (Z=92), también ha sido observada en eventos de explosiones de supernova; sin embargo, estas explosiones llamadas supernova-tipo II, son mucho menos frecuentes y no dan cuenta correctamente de las abundancias relativas de los elementos más pesados. Por lo anterior, no existe, hasta ahora, un mecanismo aceptado y confirmado que explique cómo se forma el núcleo de oro con sus 79 protones.
La evidencia reciente de la colisión de dos estrellas de neutrones brindó la posibilidad de explicar la síntesis de núcleos de oro a partir de la colisión de dos estrellas de neutrones. Las estrellas de neutrones son pequeñas (entre 10 y15 km de diámetro), respecto a otras estrellas, pero sumamente masivas, con alrededor de 1.5 veces la masa del Sol. Hace pocas meses, un grupo de astrofísicos de Harvard pudieron analizar en detalle una gran explosión ultra-corta de rayos gama, con una duración de menos de dos décimas de segundo a una distancia de 3900 millones de años-luz de la Tierra (un año-luz es la distancia que recorre la luz en un año, igual a 9 460 730 472 580 km). Los astrofísicos han observado que una colisión típica (con dos trayectorias en espiral que se encuentran en el centro) de dos estrellas de neutrones de masa media produce un hoyo negro y que, como resultado de esta colisión, hay una gran cantidad de masa eyectada en la forma de núcleos de oro, entre otros. Su estimación actual de producción de oro por colisión es de 10 masas lunares. Esto equivale, considerando la cotización actual del oro en el mundo, a 1×1028 dólares.
Evidentemente, el material eyectado, producto de la colisión de las estrellas de neutrones, contiene también muchos otros núcleos pesados, en particular, grandes cantidades de platino, mercurio y uranio. La confirmación definitiva de la nueva teoría de nucleosíntesis por colisión de estrellas de neutrones requerirá de varios años de observaciones y será una de las últimas piezas del rompecabezas en la comprensión de la formación de la materia que existe en el Universo.
La próxima vez que veamos un anillo o joya hecha en oro, recordemos que provino de la formación de un hoyo negro a partir de dos estrellas de neutrones, un evento cataclísmico y extraordinario.
Artículo publicado originalmente “El oro y las colisiones de estrellas de neutrones” en el periódico Unión de Morelos por miembros de la Academia de Ciencias de Morelos A.C.
Cómo citar: Autor, C., Alejandro Ramírez Solís Facultad de Ciencias, Universidad Autónoma del Estado de Morelos. Miembro de la Academia de Ciencias de Morelos. (2018, 21 de Septiembre ) El oro y las colisiones de estrellas de neutrones. Conogasi, Conocimiento para la vida. Fecha de consulta: Octubre 10, 2025
Esta obra está disponible bajo una licencia de Creative Commons Reconocimiento-No Comercial Compartir Igual 4.0





Deja un comentario
Sé el primero en comentar!