Conocimientos previos:
- ADN
- Gen
- Célula
- Procariota, Eucariota
- Especie
Resumen
La obtención de la secuencia del genoma humano ha quedado como una gran marca en la historia de la ciencias biologicas, siendo el comienzo de una nueva visión en el campo biológico en general y sobre todo en el ambito biomédico. Al obtener toda la secuencia genómica de un individuo es similar al obtener “el manual de instrucciones para la funcion de su cuerpo”, pero aún queda mucho trabajo para poder comprender como se lleva a cabo la gran cantidad de funciones. Aunque las cuestiones médicas sean probablemente mucho más profundas y complejas, la investigación en medicina genómica se está acercando poco a poco hacia una medicina personalizada, contando ya con predicciones genéticas para el riesgo individual de algunas enfermedades y la capacidad de respuesta de algunos fármacos. Si bien aún existen retos que se deben cumplir, aún existe un optimismo generalizado, en que la medicina genómica y su utilización en el contexto clínico, sea aplicado en un corto plazo.
Introducción
El genoma es toda la secuencia del material hereditario (ADN) dentro de una célula, tejido, órgano u organismo. La genómica humana es una rama reciente en las ciencias biológicas, y se encarga de estudiar todo el material genético de la especie Homo sapiens (ser humano). Dentro de su haber, puede incluir el estudio científico de enfermedades complejas tales como enfermedades del corazón, asma, diabetes y cáncer; debido a que estas enfermedades son frecuentemente causadas por una combinación de factores genéticos y ambientales, que por solo genes específicos. Esta área está ofreciendo nuevas posibilidades para terapias y tratamientos, así como nuevos métodos de diagnóstico. Para desarrollar estas técnicas tan sofisticadas de secuenciación del ADN, los científicos comenzaron secuenciando genomas pequeños y simples como el de los virus (yourgenome.com [1]).
Breve historia de la secuenciación genómica
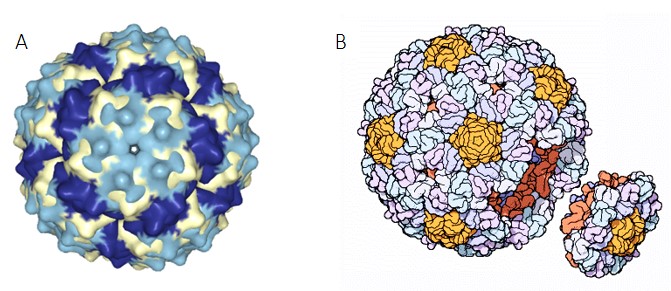
En 1976 Walter Fiers, secuenció el primer genoma (3,569 bases) de un virus llamado bacteriófago MS2 (figura 1), que es un virus de ARN de una sola cadena (monocatenario [2]) que infecta bacterias de la familia de E. coli (Fiers et al., 1976). Posteriormente, Fred Sanger se secuencia un genoma de ADN circular (figura 2) del virus PhiX174, el cual contenía 5,386 bases.
En 1995 Robert D. Fleischmann en el laboratorio a cargo de Craig Venter, secuenciaron el primer genoma de una bacteria Haemophilus influenza (1.8 millones de bases, con un cromosoma [5]), que es la bacteria responsable de un amplio rango de enfermedades como la meningitis [6], la neumonía [7] y otras de menor gravedad (medlineplus.gov [8]) (Fleischmann et al., 1995). Un año después se secuencia al primer organismo eucariota la levadura de pan Saccharomyces cerevisiae (cepa S288C). Este es un hongo utilizado en muchos procesos gastronómicos, cuenta con 12.15 millones de bases en 16 pares de cromosomas, y su secuenciación se llevó a cabo mediante una colaboración internacional por más de 100 laboratorios internacionales (The International Collaboration for the Yeast Genome Sequencing) (yeastgenome.org/ [9]) (Mewes et al., 1997).
Posteriormente, en 1998 se secuenció un gusano llamado Caenorhabditis elegans (gusano nematodo: ver video) que es un organismo modelo usado en muchas investigaciones para estudiar fenómenos biológicos particulares, y nos dan una idea de cómo funcionan estos procesos en otros organismos como en el ser humano. Este organismo fue el primer animal en ser secuenciado, y contiene 100 millones de bases distribuidos en 12 cromosomas para los individuos hermafroditas [11]y 11 cromosomas para individuos machos. Esta secuenciación fue llevada a cabo por El Instituto del Genoma en la Universidad de Washington, EUA y el Instituto “Wellcome Trust Sanger” en Cambridge, Reino Unido (The C. elegans Sequencing Consortium, 1998).
Para el año 2000, se secuenció la primera planta Arabidopsis thaliana [13], que es ampliamente utilizada como un organismo modelo en biología vegetal (The Arabidopsis Genome Initiative, 2000). Esta planta cuenta con alrededor de 135.6 millones de bases dentro de 5 cromosomas haploides [14] (plants.ensembl.org/ [15]). Y tambien en el mismo año se secuencia a la mosca de fruta Drosophila melanogaster [16], usada ampliamente en investigaciones biológicas. Este organismo fue secuenciado en colaboración una empresa privada Celera Genomics y las Universidad de Berkeley, la Facultad de Medicina Baylor y el Proyecto Europeo del Genoma de la Drosophila. Este organismo cuenta con 165 millones de bases en 4 cromosomas (Adams, 2000).
El genoma humano
A medida que las técnicas mejoraron, fue posible secuenciar los genomas de organismos más complejos, como el genoma humano. En el año 2001 comenzó el desciframiento del código del genoma humano y culminó en abril de 2003. Los investigadores completaron con éxito el Proyecto Genoma Humano, con dos años de anticipación. El objetivo del Proyecto Genoma Humano (PGH) era proporcionar a los investigadores herramientas para comprender cuales son los factores genéticos que inducen hacia las enfermedades humanas, y generar nuevas estrategias para su diagnóstico, tratamiento y prevención. Todos los datos generados por el PGH se hicieron libres y disponibles en internet (para más detalles ver https://www.ncbi.nlm.nih.gov/genome/guide/human/ [17]), y esto impulso que se acelerara el ritmo de los descubrimientos médicos en todo el mundo (ver tabla 1). Ya que la obtención de la secuencia del genoma humano es similar a la obtención de todas las páginas de un manual para conocer las funciones del cuerpo humano. Si bien ahora tenemos el manual, el desafío consiste en descifrar el contenido de estas páginas para saber como es que se mantiene una condición saludable y/o una enfermedad dentro de nuestro cuerpo (Research Portfolio Online Reporting Tools, RePORT, 2013).
Del Proyecto Genoma Humano a un mapa de variaciones genéticas: HapMap
Un paso importante hacia el entendimiento integral del genoma humano fue el desarrollo del HapMap (http://hapmap.ncbi.nlm.nih.gov/ [18]), que es un catálogo en el cual se describen las variaciones genéticas más comunes (haplotipos) dentro del genoma humano. En 2010, se publicó la tercera fase del proyecto HapMap, con datos de 11 poblaciones mundiales, la encuesta más grande de variación genética humana realizada hasta la fecha. Los datos de HapMap han acelerado la búsqueda de genes implicados en enfermedades humanas comunes y ya han arrojado resultados impresionantes en la búsqueda de factores genéticos involucrados en condiciones que van desde la ceguera relacionada con la edad hasta la obesidad (National Human Genome Research Institute, 2015). A pesar de los grandes esfuerzos en el estudio del genoma humano y de sus variaciones genéticas estos han generado avances médicos importantes, pero aún existen grandes retos por resolver como las enfermedades complejas y las del corazón que están aún lejos de ser completamente entendidas y/o aclaradas.
Tabla 1. Resultados del estudio del proyecto del genoma humano (PGH)
| Descubrimiento de genes asociados a diferentes enfermedades. | más de 1.800 |
| Pruebas diagnósticas para diversas condiciones genéticas. | más de 2,000 |
| Productos biotecnológicos resultado del PGH en ensayos clínicos. | ̴ 350 |
| Creación de un programa de implicaciones éticas, legales y sociales | http://www.genome.gov/10001618 [19] |
| Disminución de los costos de secuenciación | $1,000 dls [20] y se espera que disminuya aún mas |
| Farmacogenómica [21] un campo nuevo que examina cómo la variación genética afecta la respuesta de un individuo a un fármaco. | Ej.: se puede identificar si un paciente con leucemia responderá al fármaco mercaptopurina, o la dosis correcta de fluorouracilo (5-FU) más adecuada. |
| Nueva generación de medicamentos focalizadas | más efectivos y menos efectos secundarios |
| Análisis individualizados basado en el genoma | Medicina personalizada [21] |
Después de la secuenciación del genoma humano: Farmacogenómica y Medicina Genómica
La farmacogenómica es un campo que examina las variaciones genéticas afectan la respuesta de un individuo a un fármaco (para más detalles ver: XXX). Las pruebas farmacogenómicas actuales, ya pueden identificar si un paciente con cáncer de mama responderá o no al fármaco que habrá de administrársele o si un paciente con SIDA debe tomar o no tomar el fármaco Abacavir, o cuál debe ser la dosis correcta de warfarina más apropiada para un paciente que debe prevenir que la formación de coágulos en la sangre o en los vasos sanguíneos (para más detalles ver: medlineplus.gov [22]) (Genetics Home Reference, 2017).
Medicina genómica
El Instituto Nacional de Investigación del Genoma Humano (NHGRI) define a la medicina genómica como una disciplina médica emergente que implica el uso de información genómica sobre un individuo como parte de su atención clínica. Esta disciplina está teniendo un impacto en la clínica, específicamente en los campos de la oncología, cardiología, farmacología, las enfermedades raras y en las enfermedades infecciosas (NHGRI, 2016).
La oncología, en particular, está a la vanguardia de la incorporación de la medicina genómica, ya que los diagnósticos basados en marcadores genéticos y/o genómicos están cada vez más incluidos en la detección de un cáncer, para además guiar la estrategia de tratamiento (NHGRI, 2016).
Aplicaciones de la Medicina Genómica
Existen casos donde la medicina genómica ya se lleva a cabo en la clínica como:
- Los cánceres colorrectales con una mutación en el gen PIK3CA pueden beneficiarse después del diagnóstico con aspirina como tratamiento. Entre el 15 – 20 % de los pacientes con cáncer colorrectal tienen esta mutación y se ha descubierto que el tratamiento regular con aspirina se asocia con un aumento de la supervivencia, en comparación con los pacientes que no tienen la mutación en PIK3CA (Liao et al., 2012).
- Los recién nacidos en Estados Unidos son diagnosticados para enfermedades genéticas graves hereditarias (entre 29 – 50 enfermedades) y tratables a través de un programa de salud pública llamado “newborn screening”. La secuenciación del genoma completo permite a los médicos buscar mutaciones en todo el genoma buscando un número mucho mayor de enfermedades. Se ha demostrado que la secuenciación rápida del genoma proporciona un diagnóstico para los niños en la unidad de cuidados intensivos neonatales (Saunders et al., 2012).
- La secuenciación del ADN se utiliza para investigar brotes de enfermedades infecciosas graves, entre las que destacan el virus, cepas resistentes a fármacos de bacterias, así como intoxicación alimentaria tras la contaminación bacteriana. La secuenciación también se ha utilizado recientemente para diagnosticar meningoencefalitis bacteriana, identificando rápidamente el agente terapéutico correcto para el paciente (Diep, 2013; Wilson et al., 2014).
- La fibrosis quística es una de las enfermedades genéticas causada por mutaciones en un gen llamado CTFR [23]. Actualmente se han identificado más de 900 mutaciones diferentes de CTFR que causan fibrosis quística. Aproximadamente el cuatro por ciento de los casos son causados por una mutación (G551D) que es un cambio de aminoácidos en la posición 551 de una glicina [24] (G) por un ácido aspártico [25] (D). Actualmente se ha desarrollado un fármaco llamado Ivacaftor [26] que es extraordinariamente efectivo para tratar esta enfermedad en individuos con esta mutación en particular (Accurso et al., 2010).
Para más ejemplos ver: https://www.genome.gov/27551536/notable-accomplishments-in-genomic-medicine/ [27]
Conclusión
Después de la publicación del genoma humano, el progreso científico y tecnológico generado en últimos años, nos está acercando cada vez más hacia una medicina genómica personalizada cada vez más accesible. Y si bien aún existen retos que se deben cumplir, existe aún un optimismo generalizado, en que la medicina genómica y su utilización en el contexto clínico, en particular para orientar las prácticas de detección y la optimización de la medicación, sea aplicado en un corto plazo.
