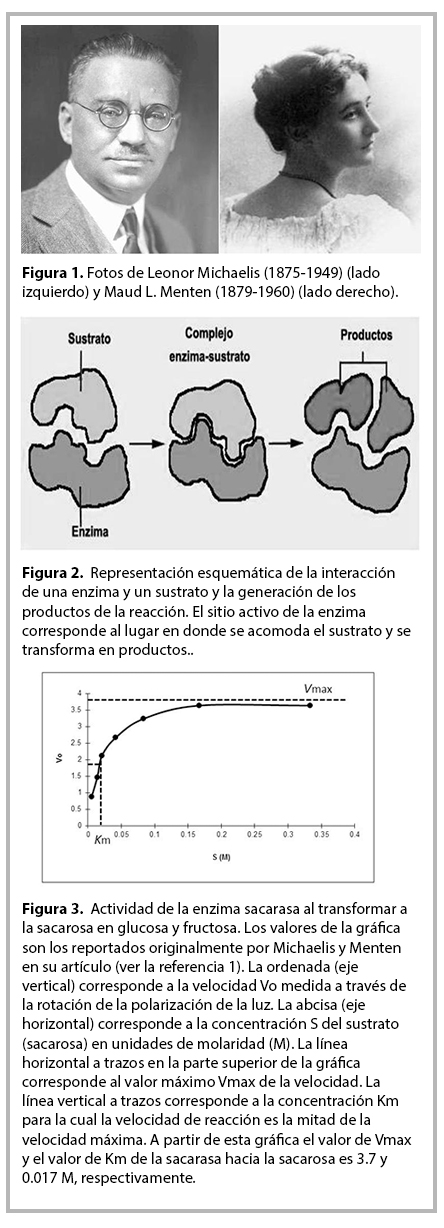
La ciencia ha tenido a lo largo de su historia periodos florecientes caracterizados por hallazgos (y publicaciones) de gran trascendencia. Este año se cumple el primer centenario de la publicación de un artículo científico que marcó un antes y un después en la historia de la Bioquímica: el artículo de Leonor Michaelis y Maud L. Menten (ver la figura 1 y la referencia 1), el cual sentó las bases para cuantificar los parámetros que caracterizan la actividad de una enzima. Antes de explicar el significado de los términos anteriores, hablemos un poco de los autores de este artículo clásico en la Bioquímica. Leonor Michaelis fue un bioquímico, fisicoquímico y médico Alemán, y Maud Menten fue una médico Canadiense. Será muy interesante para el lector enterarse que Maud Menten fue la primera mujer Canadiense en obtener el título de Doctor en Medicina, lo cual sucedió en el año 1916, es decir, tres años después de la publicación del artículo en coautoría con L. Michaelis que nos ocupa. Ambos investigadores son considerados como los padres de la “cinética enzimática”.
En estos momentos los Lectores se preguntarán: ¿qué son las enzimas? y ¿qué significa “cinética enzimática”? A lo largo de este artículo daremos respuesta a estas interrogantes en el contexto de la contribución de Michaelis y Menten. Empecemos por definir a una enzima (que abreviamos con la letra E): Las enzimas son un grupo de proteínas que participan en el metabolismo, llevando a cabo reacciones químicas de síntesis y degradación en los seres vivos. Recordemos que las proteínas, y por lo tanto, las enzimas, son biomoléculas formadas por aminoácidos. La característica principal de las enzimas es que son catalizadores de una amplia variedad de reacciones químicas. Los catalizadores aceleran las reacciones químicas en que participan por varios órdenes de magnitud, haciéndolas en ocasiones millones de veces más rápidas. Sin la participación de catalizadores, algunas reacciones químicas serían muy lentas, lo cual, en el caso de las células, sería desfavorable para los procesos metabólicos y podría ser fatal para la vida. Las enzimas tienen una región conocida como sitio activo a la que se unen moléculas denominadas sustrato (abreviado como S) formando complejos enzima-sustrato (abreviado como ES). Una vez que S se une al sitio activo de E, es transformado químicamente en productos, (que abreviamos como P) (ver la figura 2). La unión de S a E es muy específica ya que las estructuras del sitio activo de la E y del S son complementarias, a manera de un molde en el cual se puede acomodar un objeto con la forma complementaria pero no objetos con otras formas. Hasta hace unas décadas, la interacción entre la E y el S se solía representar como una llave que es complementaria a una cerradura; la llave correspondería a S y la cerradura al sitio activo de E. Otra característica importante de una enzima es que se regenera después de transformar a S en P. Por consiguiente E puede continuar uniéndose a otras S para convertirlas en P mientras queden S disponibles. Durante la transformación de S en P la afinidad de la E por el S y la eficiencia de la E para transformar al S en P desempeñan un papel muy importante. Algunas enzimas tienen una afinidad baja por S aunque son muy eficientes al transformarlo en P, o tienen una afinidad alta por S pero son poco eficientes para transformarlo en P; la situación ideal es aquella en que la enzima tiene una afinidad alta por el sustrato y una gran eficiencia para convertirlo en productos. Así, la actividad catalítica resulta de una combinación de ambos parámetros. Por lo tanto, como podrá darse cuenta el Lector, cuantificar estos parámetros es muy importante para caracterizar la actividad de una enzima y así determinar su cinética enzimática para entender su papel en el metabolismo celular y cómo su actividad puede ser regulada por otras sustancias.
Antes de la publicación del artículo de Michaelis y Menten no existía procedimiento matemático alguno que permitiera cuantificar los parámetros anteriores. En 1903 Víctor Henry notó que era necesario formar el complejo ES para que actuara una enzima. A partir de esta propuesta, Michaelis y Menten desarrollaron un procedimiento matemático para caracterizar la cinética de una enzima. Postularon que E se combina reversiblemente con S para formar el complejo ES, el cual posteriormente da lugar a la E libre y a P (ver la figura 2). Michaelis y Menten realizaron experimentos con la sacarasa, que es la enzima que transforma a la sacarosa (S) (azúcar común) en glucosa y fructosa (P). Aprovecharon la actividad óptica de la sacarosa, es decir, su propiedad de rotar la dirección en que oscila el campo electromagnético que conforma la luz polarizada, para cuantificar la velocidad de la reacción, ya que a medida que se consume S y se forma P, el ángulo de rotación disminuye. Esto fue empleado por Michaelis y Menten para medir la velocidad de reacción de la sacarasa. En la figura 3 se muestra la gráfica de la actividad de la sacarasa. Analizando estos resultados, Michaelis y Menten establecieron los parámetros que se emplean hasta nuestros días en los estudios de cinética enzimática, los cuales son: la velocidad máxima Vmax de la reacción y la constante Km de Michaelis-Menten . La velocidad Vo de la reacción se define como el número de moléculas de S que se convierten en P por unidad de tiempo. Conforme aumenta la concentración de S, aumenta el número de moléculas de la E unidas al S y Vo se aproxima asintóticamente a su valor máximo Vmax correspondiente a la saturación, cuando todas las E estarían unidas a S. La constante Km es el valor de la concentración de S para el cual la velocidad Vo alcanza un valor igual a la mitad de su valor máximo Vmax (ver la figura 3). En este momento el lector se preguntará: ¿cuál es el significado de Vmax y Km en la actividad de una enzima? El Lector podrá convencerse de que mientras más rápido se produzca P a partir del complejo ES, mayor sería la velocidad Vmax alcanzable por la reacción, mientras que mientras más rápido se forme el complejo ES, se requeriría una concentración menor de S para acercarnos a la saturación. Por lo tanto, Km caracteriza la afinidad de E por S y Vmax la eficiencia de E para transformar S en P. Como Vmax aumentaría naturalmente de tener mayor cantidad de catalizador, la eficiencia intrinseca se caracteriza por la constante catalítica Kcat, la cual se obtiene del cociente de Vmax dividida entre la concentración de E. De esta manera, el artículo de Michaelis y Menten abrió las puertas a la cuantificación de los parámetros esenciales para caracterizar la actividad de las enzimas: la afinidad de E por S y su eficiencia para transformar S en P. Ese artículo dio así lugar al nacimiento de la rama de la Bioquímica conocida como Enzimología.
Finalmente, tal vez el lector se pregunte: ¿cuál es el interés por estudiar a las enzimas mediante la cinética enzimática? Las enzimas intervienen y son absolutamente esenciales en la regulación de todas las funciones de los seres vivos. Por ejemplo, actúan durante la coagulación de la sangre, en la respuesta del sistema inmunológico y para digerir a los alimentos. Cualquier falla en el funcionamiento de alguna enzima conduce al desarrollo de una enfermedad. Tal es el caso de la fenilcetonuria, enfermedad debida al cambio de un aminoácido en la enzima fenilalanina hidroxilasa, el cual la inactiva, produciendose una acumulación del aminoácido fenilalanina, lo cual da lugar a retardo mental. Las enzimas tienen además aplicaciones amplias en diferentes sectores. Por ejemplo, en el área biotecnológica se emplean para producir medicamentos, en la industria alimentaria participan en procesos para elaborar productos de elevado consumo como quesos, cerveza y vino. También se emplean para producir detergentes y para degradar los colores de telas como la mezclilla. La comprensión detallada de las enzimas que participan en estos y en muchos otros procesos depende en gran medida del conocimiento de sus características cinéticas, incluyendo su afinidad y eficiencia. Esto es posible gracias a los estudios publicados por Michaelis y Menten hace un siglo, los cuales conservan una gran vigencia en nuestros días.
Los autores de este artículo recomiendan a los lectores interesados en profundizar en el conocimiento de las enzimas y la cinética enzimática consultar los capítulos correspondientes a estos temas en libros de texto de Bioquímica, como son los que se citan en las referencias 2 y 3.
Artículo publicado originalmente “La publicación del artículo de Michaelis y Menten: Un hito en la historia de la Bioquímica” en el periódico Unión de Morelos por miembros de la Academia de Ciencias de Morelos A.C.
Cómo citar: Autor, C., Reinier Gesto Borroto Lab. de Biofísica y Biología Molecular Depto. de Bioquímica y Biología Molecular, Facultad de Ciencias Universidad Autónoma del Estado de Morelos. Mabel Peña Marey Departamento de Ingeniería Celular y Biocatálisis Instituto de Biotecnología Universidad Nacional Autónoma de México. Raúl Arredondo Peter Lab. de Biofísica y Biología Molecular Depto. de Bioquímica y Biología Molecular, Facultad de Ciencias Universidad Autónoma del Estado de Morelos. Estudiante del Posgrado en Ciencias (Área terminal en Biología Celular y Molecular) Universidad Autónoma del Estado de Morelos. Miembro de la Academia de Ciencias de Morelos. (2018, 21 de Septiembre ) La publicación del artículo de Michaelis y Menten: Un hito en la historia de la Bioquímica. Conogasi, Conocimiento para la vida. Fecha de consulta: Abril 25, 2024
Esta obra está disponible bajo una licencia de Creative Commons Reconocimiento-No Comercial Compartir Igual 4.0




Deja un comentario
Sé el primero en comentar!